問題PDF
〔選択肢の問題の答が複数ある場合は、すべて答えなさい〕
【1】
J子さんは、重そうの粉とクエン酸の粉で入浴剤と同じ反応が起こると聞いた。
そこで、2つの粉を混ぜたものを水に入れてよくかき混ぜた。
すると、入浴剤と同じように盛んに泡が出た。また、容器をさわると少し冷たく感じた。
J子さんは、気体が逃げるとその分重さが減ると考えた。
J子さんは、重そう2gといろいろな重さのクエン酸の粉を混ぜておき、
それをビーカーに入れた40gの水に加えてかき混ぜ、
反応前と反応後の重さと温度の変化を調べた。
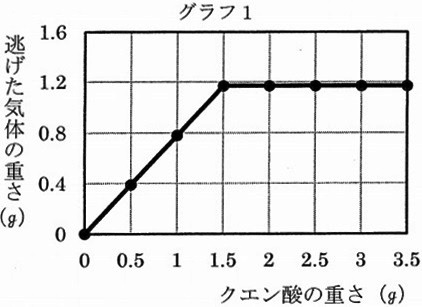
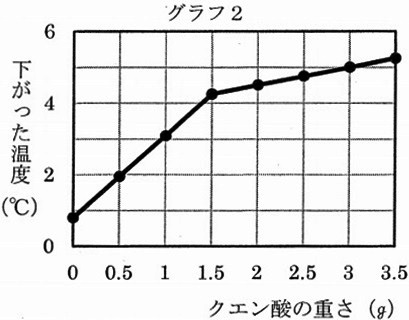
反応後にはすべての粉が溶けていた。グラフ1とグラフ2はその結果である。
(1)ここで発生した気体は石灰石にうすい塩酸を加えたときに発生する気体と同じである。
①この気体の名前を書きなさい。
②次の選択肢の中で、この気体について書かれたものを選びなさい。
ア:水素より重いが、酸素や窒素より軽い。 イ:空気中には約0.4%存在する。
ウ:都市ガスや炭を燃やしたときにできる。 エ:酸性雨の原因の一つである。
オ:水でぬらした青色リトマス紙を赤く変える。
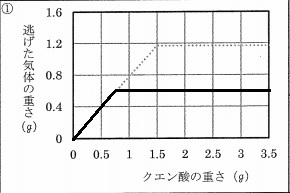
(2)グラフ1から読み取れることを選びなさい。

ア:水平になっているところでは、気体は発生していない。
イ:水平になるまでは、逃げた気体の重さはクエン酸の重さに比例している。
ウ:水平になっているところでは、反応が終わるまでの時間はすべて等しい。
エ:加熱すると反応はもっとはやく進む。
オ:発生した気体は水にあまり溶けない。
(3)グラフ1とグラフ2から考えて、重そうの粉とクエン酸の粉それぞれを水に溶かしたとき、
冷たくなる場合はA、あたたかくなる場合はB、温度が変わらない場合はCとして答えなさい。
また、それはグラフのどの部分からわかることか、グラフの横軸の値を表した次から選びなさい。
ア:0 イ:0~1.5 ウ:1.5 エ:1.5~3.5
(4)40gの水に次の①、②を溶かしたとき、水の温度はもとの温度から何℃変化すると考えられるか。
下の表を使って計算し、答えは、四捨五入して小数第一位まで求めなさい。
ただし、溶けたときに出入りする熱はすべて水の温度の変化に使われるものとする。
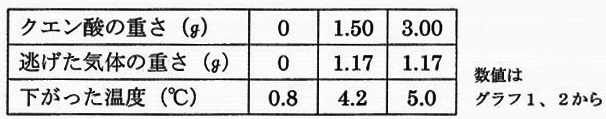
①重そう1g ②クエン酸2g
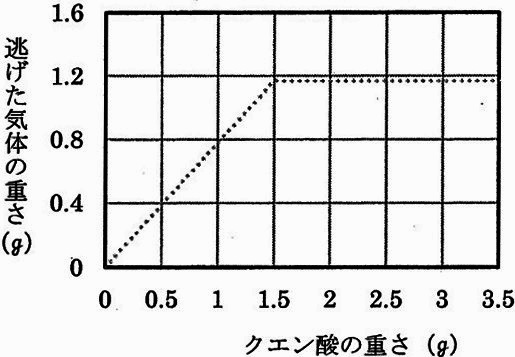
(5)重そうを1g、水を20gに変えて同様に実験を行った。
①クエン酸の重さと逃げた気体の重さの関係を表すグラフは、どのような形になると考えられるか。
解答欄にかき入れなさい。点線は重そう2g、水40gのときのグラフである。
②クエン酸の重さと下がった温度の関係を表すグラフは、グラフ2と同じように途中からグラフの傾きが変化した。前半の直線の傾き、後半の直線の傾きは、グラフ2と比べてどうなるか、それぞれ選びなさい。
ア:小さくなる(ゆるやかになる) イ:変わらない ウ:大きくなる(急になる)
【2】
(1)重そう、クエン酸をそれぞれ水に溶かし、紫キャベツ液を加えると、
重そうの水溶液は緑色、クエン酸の水溶液は赤色になった。
紫キャベツ液を加えたときの色がそれぞれの水溶液と同じになるものを選びなさい。
ア:アンモニア水 イ:うすい塩酸 ウ:食塩水 エ:食酢 オ:水酸化ナトリウム水溶液
(2)すべての酸性の水溶液にあてはまる性質を選びなさい。
ア:青色リトマス紙を赤色に変える。 イ:気体が溶けた水溶液である。
ウ:アルミニウムを加えると気体が発生する。エ:鉄や銅の表面にできたさびを溶かす。
(3)酸性やアルカリ性によって色が変わっている現象を選びなさい。
ア:砂糖水を加熱し続けると茶色くなった。
イ:紅茶にレモンを入れると、色がうすくなった。
ウ:赤じそを加えて梅干しを作るとあざやかな赤色になった。
エ:石灰水に二酸化炭素を通すと白く濁った。
オ:紙に紫色のペンで書いたところが水でぬれて、ピンク色と青色に分かれた。
@解説@
選択肢問題はすべて式なので、正確な正誤判定が求められる。
1(1)①二酸化炭素
石灰石+塩酸→二酸化炭素の発生。
②ウ・オ
二酸化炭素の性質を問う。
ア:酸素や窒素(空気)よりも重い。× イ:空気中の約0.04%。×
ウ:有機物の燃焼などで発生する。
排出量で最も多いのは化石燃料(石油/石炭/天然ガス)の燃焼。〇
エ:酸性雨の原因物質は窒素酸化物(NOx)と硫黄酸化物(SOx)。×
オ:炭酸水は酸性で青リトマスを赤に変える。〇
(2)イ
グラフ1から読み取れることを選ぶ。けっこう難しい。

ア:クエン酸1.5g以上でも逃げた気体は1.2g発生している。×
イ:クエン酸1.5gまでは比例関係。〇
ウ:反応の時間はグラフでは示されていない。×
エ:温度の情報がない。×
オ:微妙な判断を要する(-_-;)
水と反応させて発生した気体は水に溶けにくそうではあるが、
水にそこそこ溶ける気体がそこそこ水に溶けたあとの残りが
気体としてあらわれ、図1のグラフで示されたかもしれない。
つまり、図1だけでは発生した気体の水の溶けやすさは決まらない。×
(3)重そう…A・ア クエン酸…A・エ
〔重そう+水〕と〔クエン酸+水〕のときの温度変化を答える。
重そうとクエン酸は一緒に入れないことに注意!


重そう…クエン酸0gのところは、重そうと水しかない。
グラフ2ではクエン酸0gのときに温度が下がっている。
クエン酸…グラフ1・2より、クエン酸1.5gでグラフが折れている。
すなわち、クエン酸1.5gで中和反応が終わり、重そう2gがなくなった。
1.5~3.5gはクエン酸+水だが、温度は下がり続けている。
横軸が0gより大きく、1.5gより小さいところ(イ)は、重そうとクエン酸が混合しており、
中和熱の影響もあるので選んではならない。
(4)①0.4℃

問題文は重そう2g。クエン酸なしで(重そうのみで)0.8℃下がった。
重そう1gでは、0.4℃下がる。
②1.1℃
クエン酸1.5gで重そうは消える(1.5g以上はクエン酸のみ)
表より、3-1.5=1.5gのクエン酸で、5.0-4.2=0.8℃下がる。
2gのクエン酸では、0.8×2/1.5=1.0666… →1.1℃下がる。
(5)①
重そう2gに対して、クエン酸は1.5gで中和する。
重そうの量を半分にしたので、中和反応も1.5gの半分で終わる。
逃げた気体の重さも同様。
②前半…ウ 後半…ウ

↑重そう2g、水40gのとき。
重そう1g、水20gのときの温度変化の度合いを考える。
量が半分なので中和反応は半分で終わるが、
同じ濃度であれば、重曹2g:クエン酸1.5gの比で中和は進むので、
中和反応が終わるまでは同じように温度が下がり、
反応が終わったあとも同じように温度は下がる。
水の量が半分になった点に注意。水の量が半分になると、温度の変化は2倍になる。
(極端な話、鍋1杯の水を沸騰させるのと、25mプールすべての水を沸騰させる場合、
同じ100度の水にするために必要な熱エネルギーは倍以上であると想像できるはず)
温度が下がる吸熱反応も同じで、水の量が2倍になると温度の下がり具合は半分になり、
水の量が半分であれば水分子の量が少ないので2倍速で冷える。
2(1)①重そう…ア クエン酸…イ・エ
紫キャベツは中性だとそのまま紫、弱酸でピンク、強酸で赤となり、
弱アルカリで青、強いアルカリほど緑、黄色へと変わっていく。
酸性・アルカリ性だけではなく、強弱まで知らないと答えられない。
重曹(炭酸水素ナトリウム)水…弱アルカリ。クエン酸…弱酸。
アンモニア水‥弱アルカリ。うすい塩酸…塩酸が強酸なので、濃度を薄めると弱酸。
食塩水…中性。食酢…主成分は酢酸で弱酸。水酸化ナトリウム水溶液…強アルカリ。
(2)ア
酸性の溶液の性質を問う。
ア:青色リトマスを赤色に変える。○
イ:本文のクエン酸は白い粉。溶質(水溶液に溶けている物質)は気体に限らない。×
ウエ:そんな気もするが、確証が得づらい。
炭酸水を思い出し、ソーダにアルミニウムやサビた鉄と銅を入れても、
二酸化炭素の気泡がつくだけで金属はそのまんまであると思いつけるかどうかか…。×
(3)イ・ウ
ここも確証をもって消しにくい。くわえて、すべて式なので難。
ア:有機物である砂糖の炭素が燃焼で焦げた。×
イ:紅茶の色素であるテアフラビンが酸性になると無色になるらしい。
ウ:木になっている梅は緑色。赤シソをもむと濃い紫色のシソニンがでて、
シソニンが梅のクエン酸と反応して赤に変わり、その赤が梅に浸透するそうです。
エ:石灰水に二酸化炭素をさらすと、白い炭酸カルシウムが沈殿する。
酸とアルカリの反応ではない。×
オ:ピンクと青をあわせると紫になるので、紫の成分が水にぬれて青とピンクに分離した。×
水に塗れただけなので中和反応ではないと考えるしかないような…。
吸着率の違いで物質を分離する方法をクロマトグラフィーという。
>ペーパークロマトグラフィー~紙と水とで色を分ける~(産総研サイエンスタウン)
詳しくは上記リンク先をみてください。


コメント