問題PDF
表1は、水の温度と物質Aが水100gに溶ける最大の重さの関係を示したものです。
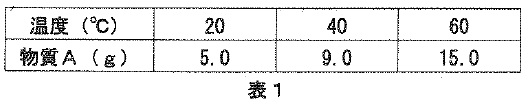
計算問題の答えは、整数または小数で答え、
割り切れない場合は小数第2位を四捨五入して、小数第1位まで答えること。
(1)
20℃における物質Aの飽和水溶液が100gあった場合、何%の濃さになりますか。
(2)
60℃における物質Aの飽和水溶液100gを40℃まで下げた場合、
溶けきれなくなって出てくる物質Aは何gですか。
次に、物質Aと水に溶けない物質Bを均一に混ぜたものをXg用意しました。
物質Bの量を求めるために、実験1~4を行いました。
実験1:Xgを三等分し、ビーカー①~③に入れました。
実験2:ビーカー①にある量の水を加え20℃にしたところ、
19.0gの固体が溶けずに残りました。
実験3:ビーカー②に実験2と同じ量の水を加え40℃にしたところ、
14.2gの固体が溶けずに残りました。
実験4:ビーカー③に実験2と同じ量の水を加え60℃にしたところ、
10.0gの固体が溶けずに残りました。
(3)
Xg中に含まれていた物質Bは何gですか。
(4)
実験2で加えた水の量は何gですか。
@解説@
(1)4.8%
5%じゃないよ!
20℃では水100gに対し、物質Aは5.0g溶ける(水溶液は105g)
水溶液を100gにしたとき、物質Aは5×100/105=100/21g溶ける。
濃度は、100/21÷100×100=100/21%=4.76…%≒4.8%
(2)5.2g
60℃の水100gに物質Aは15g溶ける(水溶液は115g)
60℃100gの飽和水溶液に溶ける物質Aは、15×100/115g
40℃100g飽和水溶液に溶ける物質Aは、9×100/115g
よって、15×100/115-9×100/115
=(15-9)×100/115=120/23=5.21…≒5.2g
@別解@
はじめは水溶液115gと仮定して計算することもできる。
60℃の水100gにAは15g溶ける(115gの水溶液)
40℃の水100gで9g溶けるので、6gが析出されて出てくる。
ここで、水溶液115g→100gに切り替える。
(一定の水溶液に溶ける物質Aの量の割合は変わらない)
析出量は、6×100/115=5.21…≒5.2g
(3)30g
①20℃水+19g
②40℃水+14.2g
③60℃水+15g
おのおのの水の量は等しいが、何gの水かわかっていない。
ここで水100gの表1を確認。

溶解度の差に注目する。
20℃→40℃では4g、40℃→60℃では6gの差がある。
(20℃→40℃):(40℃→60℃)=4:6=【2】:【3】
この溶解度の差の比は、水の量が変わっても変わらない。
①20℃水+19g
②40℃水+14.2g
③60℃水+10g
①→②…19-14.2=4.8g
4.8gを【2】とすると、【3】は7.2gになるが、
②→③では、14.2-10=4.2gしか溶けなかったということは、
③のビーカーは物質Aがすべて溶けた状態で、固体はBしかないことになる。
よって、Xに含まれていた物質Bは10×3=30g
(4)120g
物質Bを除いて物質Aだけにすると、
①20℃水+9g
②40℃水+4.2g
③60℃水+0g
本問も溶解度の差に注目する。
①と②におけるAの差は、9-4.2=4.8g
表1で、水100gのときに20℃→40℃の溶解度の差は4gだったので、
実験2で加えた水の量は、100×4.8/4=120g



コメント