問題PDF
水酸化ナトリウム水溶液を蒸発皿に入れて二酸化炭素を十分に溶かした後、
水を完全に蒸発させると、水酸化ナトリウムとは別の白い固体が残ります。
いま、ある濃さの塩酸100mLを入れた蒸発皿に、水酸化ナトリウム水溶液を加えました。
さらに、この水溶液に二酸化炭素を十分に溶かした後、水を完全に蒸発させると、
白い固体が残りました。加える水酸化ナトリウム水溶液の体積をいろいろ変えたところ、
残った白い固体の重さは下の表のようになりました。

問1
表中の(ア)~(ウ)にあてはまる値を小数第三位まで答えなさい。
問2
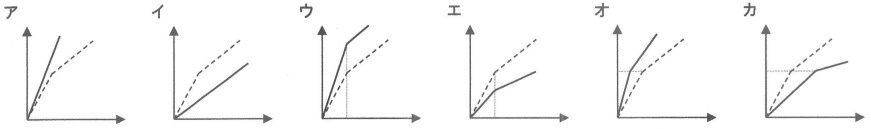
表の関係をグラフの点線---で表しました。グラフの横軸は水酸化ナトリウム水溶液の体積〔mL〕、縦軸は白い固体の重さ〔g〕を表します。加える水酸化ナトリウム水溶液を濃くしたときと、うすくしたときのグラフはどうなりますか。おおよその形として最も適するものをそれぞれ選びなさい。
問3
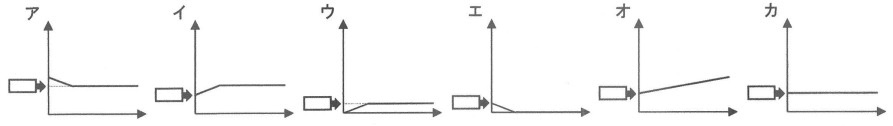
次に、初めに使ったのと同じ水酸化ナトリウム水溶液25mLを入れた蒸発皿に、初めに使ったのと同じ塩酸を加えました。さらに、この水溶液に二酸化炭素を十分に溶かした後、水を完全に蒸発させると、白い固体が残りました。加える塩酸の体積をいろいろ変えたとき、塩酸の体積と、できた白い固体の重さの関係を表したグラフはどうなりますか。おおよその形として最も適するものを選びなさい。ただし、グラフの横軸は塩酸の体積〔mL〕、縦軸は白い固体の重さ〔g〕を表します。また、選んだグラフの空らんにあてはまる数値を小数第三位まで答えなさい。
@解説@
水酸化ナトリウム+CO2で水を蒸発させると「白い固体」が残る。
この固体の名前はわからない。
水酸化ナトリウム+塩酸で同じことをすると、中和反応で白い固体(食塩)が残る。
手順は中和反応が先。塩酸との反応後に水酸化ナトリウムが残っていると、
二酸化炭素と反応して得体の知れない「白い固体」ができる。
つまり、表の白い固体の重さは、食塩と「白い固体」の合計である。
問1:ア―0.468、イ―0.797、ウ―1.327

水酸化ナト水が少ないうちは、塩酸100mLとの中和反応でなくなってしまう。
最初の白い固体は食塩だけ。
5mLの水酸化ナト水で0.117gだから、
0.117×20/5=0.468g(ア)
25mLまでは5mLごとに0.117gずつ増えているが、30mLでは計算が合わない。
30mL以降の差はすべて0.106g
0.691+0.106=0.797g(イ)
1.221+0.106=1.327g(ウ)
問2:濃くしたとき―オ、うすくしたとき―カ

グラフが折れ曲がる点まで中和反応が起きる。
水酸化ナト水の濃度を濃くすると、少ない量の水酸化ナト水で塩酸がなくなる。
そのときの食塩の量は塩酸100mLと反応する分だから、表の場合と等しい。
二酸化炭素を十分に溶かすので、濃度の濃い方がよく反応して「白い固体」が多く残る。
濃度が薄いと塩酸をすべて反応させるまで多くの水酸化ナト水を要する。
二酸化炭素との反応でできる「白い固体」の量も少なくなる。
問3:イ、0.530

今度は水酸化ナトリウム水溶液を25mLに固定して塩酸の量を調整する。
折れ曲がる地点は中和反応が終わる100mL
それ以降は水酸化ナトリウムがないので、二酸化炭素と塩酸だけになる。
「白い固体」は発生しないのでグラフは横ばい。
塩酸を全くいれないとき、水酸化ナトリウム水溶液と二酸化炭素の反応が起こる。
表より、水酸化ナト水5mLごとに「白い固体」は0.106gだから、25mLでは0.106×5=0.530g
@@
2NaOH(水酸化ナトリウム)+CO2(二酸化炭素)
→Na2CO3(炭酸ナトリウム)+H2O(水)
「白い固体」の正体は炭酸ナトリウムである。


コメント